来源:福建物构所
近年来,光学疗法作为恶性肿瘤治疗领域的新兴治疗手段,凭借其高精准定位性、低创伤性及有限的毒副作用,正逐步成为科研与临床关注的焦点。其中,基于生物分子的光疗材料,尤其是兼具优异生物相容性与独特手性特征的材料,更是成为肿瘤光疗领域探索的前沿和热点。然而,传统生物光疗材料存在生物组织的穿透能力有限及肿瘤部位蓄积量不足等问题,加之对手性结构在光疗中作用机制的深入理解欠缺,严重制约了其向临床转化的进展。
面对这一挑战,中国科学院福建物质结构研究所/闽都创新实验室的陈学元团队取得了重要进展。他们开发了一种新型近红外圆偏振光响应型量子点水凝胶(CuInSe2@ZnS QDs@L/D-Gel),该材料在小鼠活体肿瘤的光学治疗中展现出非凡潜力(图1)。团队通过精细调控铜铟硒核壳结构量子点(CuInSe2@ZnS QDs)与氨基酸分子的自组装路径,构建出纳米尺度的左/右手性螺旋纤维结构,进而形成了手性超分子量子点水凝胶(QDs@L/D-Gel)(图2a-b)。这一设计不仅拓宽了材料的光响应范围,覆盖了从紫外到近红外的宽激发光谱区域(激发波长:300-900 nm),还赋予了材料优异的近红外圆偏振发光性能(发射波长:778-1054 nm)。尤为引人注目的是,其吸收不对称因子和发光不对称因子分别达到1.3 × 10-2和3.4 × 10-3(图2c-d),这些数据表明该材料在光与物质相互作用过程中具有很高的手性选择性,为实现精准光疗提供了有力支持。
在体外实验中,当采用808 nm左旋圆偏振光(LCP)作为光源进行照射时,左手性QDs@L-Gel展现出了高达43%的光热转换效率(PCE),同时活性氧(ROS)产率也实现了显著提升。这一表现相较于常规激光器线偏振光(LP)照射下的结果(PCE 仅为 36%,且ROS产率明显不足)而言,具有显著优势(图2e-g)。此发现揭示了手性超分子水凝胶对手性匹配圆偏振光的高度选择性吸收特性和在光热/光动力治疗中的独特优势。
进一步地,在小鼠活体肿瘤治疗实验中,左手性QDs@L-Gel的优异性能得到了充分验证。该材料在肿瘤部位的驻留时间显著延长(> 72 h),远超传统量子点通常的驻留时间(< 24 h)。这一特性确保了治疗材料在肿瘤病灶区域的有效积累与稳定性,为后续的精准治疗奠定了坚实基础。通过808 nm LCP光辐照,团队实现了高达83%的肿瘤抑制率,这一效果明显优于同等条件下采用LP光进行治疗的结果(仅为32%)(图2h-j)。上述实验结果不仅证实了通过调控入射光的手性可以显著提升肿瘤部位手性超分子水凝胶的光热转换效率和ROS产率,还为实现高效、精准的光热/光动力联合治疗策略提供了重要的实验依据。
综上所述,该研究成果不仅是对传统生物光疗材料的一次重大革新,更为恶性肿瘤的光学治疗开辟了新的路径。该研究以“Near-infrared circularly polarized light triggered phototherapy based on hybrid CuInSe2 quantum dot hydrogels”为题,于2024年8月10日在线发表于《Nano Today》(Nano Today2024,58,102436. DOI: 10.1016/j.nantod.2024.102436)。论文的第一作者是中国科学院福建物构所与福州大学联合培养的博士研究生高航,通讯作者为中国科学院福建物质结构研究所/闽都创新实验室的刘?副研究员和陈学元研究员。该工作得到科技部国家重点研发计划、国家自然科学基金和福建省自然科学基金等项目支持。
此前,陈学元团队已在稀土荧光生物探针、肿瘤微环境响应纳米药物及上转换超分子材料等相关领域取得了多项重要进展。例如,研发出肿瘤微环境响应/肾清除型稀土-核苷酸自组装纳米药物,实现了对肿瘤部位的精准无毒治疗(Angew. Chem. Int. Ed.2022,61,e202116983);定制设计了新型上转换超分子有机-无机杂化材料,用于肿瘤近红外圆偏振光的精准控制治疗(Chem. Eng. J.2023, 474, 145429);还开发了基于卟啉MOF-稀土上转换纳米平台的高效光动力抗菌治疗技术(Nano Today2024,54, 102089)。
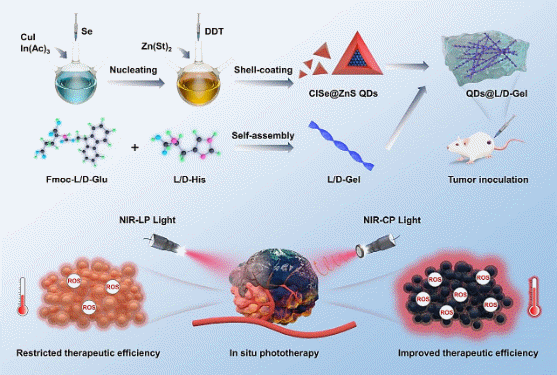
图1. 近红外圆偏振光响应型量子点水凝胶QDs@L/D-Gel的构建及肿瘤光疗示意图
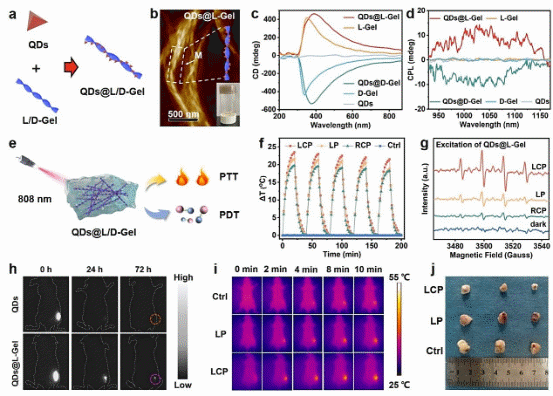
图2. QDs@L/D-Gel的(a)制备流程示意图、(b)AFM形貌图、(c)圆二色谱图、(d)圆偏振光谱图和(e)光热/光动力治疗示意图。QDs@L-Gel的(f)光热升温趋势图、(g)顺磁波谱图、(h)肿瘤驻留时间对比图、(i)体内红外热成像图及(j)光疗后肿瘤照片
